MODELO ATOMICO DE LEWIS
QUIMICA
MODELO ATOMICO DE LEWIS
Esta fue formulada en el año de 1902 por Gilbert N. Lewis. Aunque sería publica en 1916, sobre el cual se muestra la estructura de cómo están repartidos los electrones dentro de cada átomo, según su elemento químico y sus enlaces entre sí. Pares de electrones, enlaces y electrones solos entre átomos dependiendo las moléculas .
Consiste en la comprensión sobre cómo trabajan los enlaces químicos a nivel molecular. Trazando la unión de dos y tres enlaces según el modelo de átomo cubico, donde los bordes del cubo A, se unen con el B uniendo sus cuatro rincones, y realizando una transferencia o cambio de electrones para formar un nuevo elemento. Los electrones trazan un punto y una línea que forma su estructura cubica al enlazarse a otro átomo.
Este modelo de estructura atómica se utilizó para explicar el fenómeno de la valencia. Explica la formación de los electrones según los elementos de la tabla periódica de Lewis. Estas formas cubicas de los átomos se emplearon para explicar los enlaces químicos a nivel molecular.
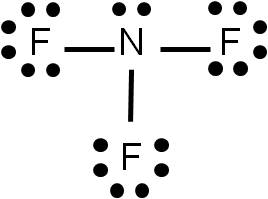
- Existen dos grupos de átomos: Centrales y Terminales. el primero con menor carga electronegativa que el segundo.
- Regla del Octeto: formula la regla de 8 electrones para mantener la estabilidad de un elemento químico.
- Los electrones de valencia forman una interacción entre dos o tres moléculas según su geometría.

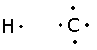
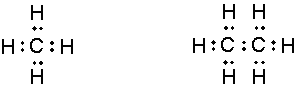
Comentarios
Publicar un comentario